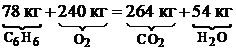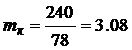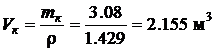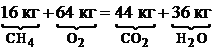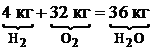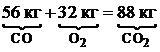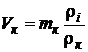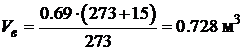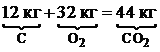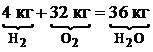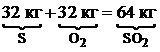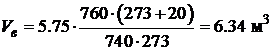|
4.3. РАСЧЕТ КОЛИЧЕСТВА ВОЗДУХА, НЕОБХОДИМОГО ДЛЯ ГОРЕНИЯ В процессе горения любых топлив участвует большое количество воздуха. Так, для полного сгорания 1 кг дров требуется (4÷5) м3 воздуха, 1 кг каменного угля – (8÷9) м3, 1 кг нефти – (10÷12) м3. При пожарах, где горение протекает с большим избытком воздуха, эти цифры увеличиваются в полтора-два раза. В табл. 4.3 приведены значения теоретического (минимально необходимого) количества воздуха, для полного сжигания некоторых горючих веществ. Приведенные в табл. 4.3 значения, являются осредненными, так как химический состав древесины, торфа, нефти и угля может существенно различаться.
Таблица 4.3 Количество воздуха, необходимое для полного сгорания 1 кг горючего
Для расчета горения конкретного топлива проводят расчет материального баланса процесса горения. Порядок расчета зависит от вида топлива. Рассмотрим основные методы расчета. Горючее вещество – определенное химическое соединение Если горючее вещество представляет собой определенный химический элемент или соединение, то для него можно записать уравнение химической реакции горения. В этом случае, независимо от агрегатного состояния вещества (твердое, жидкое или газообразное), необходимое для полного сгорания количество воздуха определяется непосредственно по уравнению реакции горения. Для проведения расчетов необходимо знать относительные молекулярные массы основных веществ, участвующих в горении. В табл. 4.4 приведены значения М для основных компонентов органических и углеводородных топлив. Отметим, что азот воздуха не участвует в горении и является инертным веществом, так же как и входящие в состав воздуха инертные газы. Таблица 4.4 Относительные молекулярные массы веществ
Рассмотрим порядок расчета на примере горения бензола С6Н6. · Запишем уравнение реакции горения: С6Н6+7.5О2=6СО2+3Н2О. · В это уравнение подставим значения относительных молекулярных масс входящих в него элементов: 6×12+6×1+7.5(2∙16)=6(1∙12+2×16)+3(1×2+1∙16). Поскольку молярная масса M (кг/кмоль) вещества численно совпадает с его относительной молекулярной массой, последнее соотношение можно записать в виде:
Таким образом, для сжигания 78 кг бензола C6H6 необходимо 240 кг кислорода. · Определим массу кислорода mк, необходимую для сжигания 1 кг бензола:
· По известной плотности кислорода при нормальных физических условиях (rн=1.429 кг/м3), взятой из табл. 4.1, определим объем кислорода Vк, необходимый для полного сгорания 1 кг бензола:
· Поскольку горение происходит в среде воздуха, расчет объема воздуха проведем с учетом объемного содержания кислорода в воздухе (21 %): Vв=2.155∙4.762=10.262 м3. Таким образом, для полного сгорания 1 кг бензола при нормальных физических условиях необходимо 10.262 м3 воздуха. · Проведем расчет объема воздуха при заданных условиях (например, при Т=+20°С (293 К), р=750 мм Hg) с помощью формулы 4.6:
Таким образом, для полного сгорания 1 кг бензола при заданных условиях необходимый объем воздуха составляет Vв=11.16 м3. Горючее вещество – смесь газов К этой группе веществ относятся технические горючие газы – природный, светильный, водяной, генераторный, колошниковый и другие. Все они могут содержать окись углерода СО, метан СН4, водород Н2, сероводород Н2S и другие компоненты. Кроме того, они могут содержать азот N2 и кислород О2. Азот, как было отмечено ранее, является инертным веществом и не участвует в реакции горения. Содержащийся в газах кислород является окислителем, и при составлении уравнений баланса массы вычитается. Исходными данными для расчета являются процентный состав газа (объем. %), температура Т и давление р воздуха. Порядок расчета необходимого количества воздуха рассмотрим на примере горения колошникового газа при Т=+15°С, р=760 мм Hg. Состав газа и плотности входящих в него компонентов при нормальных физических условиях приведены в табл. 4.5. Таблица 4.5 Состав колошникового газа
· Запишем уравнения реакций горения входящих в смесь газов. Горение метана: СН4+2О2=СО2+2Н2О. Горение водорода: 2Н2+О2=2Н2О. Горение угарного газа: 2СО+О2=2СО2. Азот N2 является инертным веществом, а углекислый газ СО2 – продуктом полного горения, поэтому для них уравнения химических реакций не записываются. · Подставим в эти уравнения молекулярные массы входящих в них элементов.
Для горения метана:
Для горения водорода:
Для горения угарного газа:
· Определим массу кислорода, необходимую для полного сгорания 1 кг каждого из компонентов смеси.
Для горения метана:
Для горения водорода:
Для горения угарного газа:
· Определим объем кислорода, необходимый для полного сгорания 1 м3 каждого из компонентов смеси по формуле
где
Для горения метана:
Для горения водорода:
Для горения угарного газа:
· Определим общий объем кислорода, необходимый для полного сгорания 1 м3 колошникового газа по формуле:
Кислород, содержащийся в составе смеси (1 объем.%), частично замещает кислород воздуха при горении, поэтому в уравнении берется со знаком «минус».
Подставляя в (4.7) значения
· Определим требуемое количество воздуха при нормальных физических условиях (с учетом того, что на 1 м3 кислорода приходится 4.762 м3воздуха):
· Проведем расчет объема воздуха при заданных условиях (Т=+15°С, p=760 мм Hg):
Таким образом, для полного сгорания 1 м3 колошникового газа в рассматриваемых условиях необходимо 0.728 м3 воздуха. Определяемое таким образом количество воздуха называется теоретически необходимым. Практически при горении на пожарах и в горелочных устройствах различного типа, реальный расход воздуха значительно больше. Отношение реального расхода воздуха к теоретически необходимому называется коэффициентом избытка воздуха. В печах, камерах сгорания и других технических устройствах коэффициент избытка воздуха a=1.1÷1.5, при пожарах эта величина может быть существенно больше и достигать значений a>2. Горючее вещество – смесь сложных химических соединений Многие горючие вещества являются сложными химическими соединениями или смесями, которые трудно или невозможно описать определенной химической формулой (например, черный порох, твердые ракетные топлива, древесина, торф, уголь, нефтепродукты и т.д.). Это, как правило, твердые или жидкие топлива. Элементарный состав таких топлив записывается в виде эквивалентной формулы или суммы содержания в них элементарных веществ (масс. %) –углерода, водорода, кислорода, серы, азота. Определение элементарного состава вещества производится лабораторным анализом. Если в состав топлива входит влага W (вода) и зола А (негорючие вещества), то элементарный состав записывается с учетом этих компонентов. В качестве примера рассмотрим торф, содержание отдельных элементов в котором приведено в табл. 4.6. Таблица 4.6 Элементарный состав торфа
Эквивалентная формула данного вещества записывается в следующем виде:
Рассмотрим порядок расчета необходимого количества воздуха на примере сгорания 5 кг торфа (табл. 4.6) при давлении р=740 мм Hg и температуре Т=20°С. · Запишем уравнения реакций горения для горючих компонентов, входящих в состав торфа (углерод, водород, сера). Горение углерода: С+О2=СО2. Горение водорода: 2Н2+О2=2Н2О. Горение серы: S+О2=SО2. · Подставим в эти уравнения молекулярные массы входящих в них элементов.
Для горения углерода:
Для горения водорода:
Для горения серы:
· Определим массу кислорода, необходимую для полного сгорания 1 кг каждого из элементов.
Для горения углерода:
Для горения водорода:
Для горения серы:
· Определим массу кислорода, необходимую для полного сгорания 1 кг торфа:
Кислород, содержащийся в торфе (24 масс.%), частично замещает кислород воздуха при горении, поэтому в уравнении берется со знаком «минус». · Определим требуемую массу воздуха (с учетом того, что на 1 кг кислорода приходится 4.348 кг воздуха):
· Определим требуемый объем воздуха при горении при нормальных физических условиях:
· Проведем расчет объема воздуха при горении 1 кг торфа при заданных условиях (Т=+20°С, p=760 мм Hg):
· Найдем объем воздуха, необходимый для полного сгорания 5 кг торфа при заданных условиях:
Таким образом, для полного сгорания 5 кг торфа при заданных условиях необходимо 31.7 м3 воздуха.
|