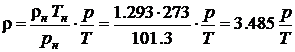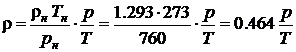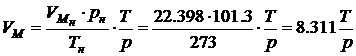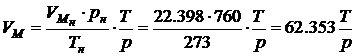|
4. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ Для оценки вероятности возникновения пожара и его последствий для конкретных объектов (нефте- или газопровод, заводской цех, складское помещение, жилая квартира, коттедж и т.д.) необходимо уметь рассчитывать материальный баланс процессов горения различных горючих веществ. Горение веществ при пожаре происходит почти всегда в среде воздуха. Только в специально приготовленных смесях (ракетное топливо, термитный состав, взрывчатое вещество) или при газовой сварке металлов горение происходит за счет кислорода, выделяемого окислителем, или за счет газообразного кислорода. Поэтому рассмотрим методы расчета материального баланса при горении топлив в среде воздуха. Расчет сводится к решению следующих задач. · Определение количества воздуха, необходимого для горения. · Определение количества и состава продуктов сгорания. 4.1. СОСТАВ АТМОСФЕРНОГО ВОЗДУХА Поскольку воздух является одним из основных компонентов горючей смеси, приведем данные по его характеристикам. Состав атмосферного воздуха достаточно сложен. Кроме основных компонентов – кислорода О2 и азота N2, в нем содержатся инертные газы (аргон, неон, гелий, криптон, ксенон), озон О3, углекислый газ СО2, пары воды H2O и частицы аэрозолей (пыль). Однако объем второстепенных компонентов в сухом очищенном воздухе не превышает 1%. Поэтому будем считать, что воздух состоит из двух компонентов – кислорода и азота. Характеристики этих газов при нормальных физических условиях приведены в табл. 4.1. Таблица 4.1 Характеристики воздуха при нормальных физических условиях
Под нормальными физическими условиями понимаются следующие значения температуры и давления: Т=0°С (273 К); р=760 мм ртутного столба (мм Hg) или 101.3 кПа. В табл. 4.1 приняты следующие обозначения: М – относительная молекулярная масса; r – плотность газовой фазы, кг/м3; R – удельная газовая постоянная Дж/(кг×К); VM – молярный объем (объем килограмм–моля) газа при нормальных физических условиях, м3/кмоль. Как следует из табл. 4.1, в 1 м3 воздуха содержится 0.21 м3 кислорода, следовательно, на 1 м3 кислорода приходится Vв=1/0.21=4.762 м3 воздуха. Соответственно, на 1 кг кислорода приходится mв=1/0.23=4.348 кг воздуха. Если процесс горения происходит с участием воздуха, параметры которого отличаются от нормальных (Т ¹ 00С и р ¹ 760 мм Hg), то плотность воздуха рассчитывается с помощью уравнения состояния (уравнения Менделеева–Клапейрона):
где Т – абсолютная температура. Уравнение состояния (4.1) для нормальных условий записывается в виде
где pн, rн, Rн, Тн – значения соответствующих параметров при нормальных физических условиях.
В предположении R= Rн=const, разделив (4.1) на (4.2), можно получить формулы для расчета плотности воздуха при произвольных значениях p, T.
если давление выражено в кПа.
если давление выражено в мм Hg. Аналогично можно получить формулы для расчета молярного объема воздуха при произвольных значениях p, T.
если давление выражено в кПа.
если давление выражено в мм Hg. Единицы давления связаны следующими соотношениями: 1 мм Hg = 133.3 Па; 1 Па = 0.0075 мм Hg. Формулы, подобные (4.3)–(4.6), можно получить для любых газообразных компонентов горючей смеси и газообразных продуктов горения по известным физическим параметрам газов при нормальных физических условиях.
|
||||||||||||||||||||||||||||||