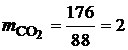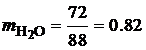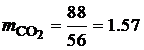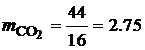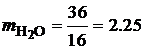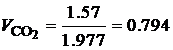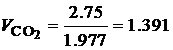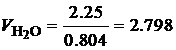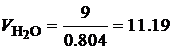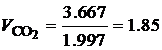|
4.4. РАСЧЕТ КОЛИЧЕСТВА И СОСТАВА ПРОДУКТОВ ГОРЕНИЯ Знание количества и состава продуктов горения необходимо для расчета важнейших характеристик процесса горения – температуры горения, температуры взрыва, давления при взрыве. Поскольку продукты сгорания находятся, как правило, в газообразном состоянии, их состав выражается либо в объемных процентах, либо в м3 на 1 кг горючего вещества. В зависимости от состава горючего вещества выбирается порядок расчета. Горючее вещество – определенное химическое соединение Если горючее вещество (твердое, жидкое или газообразное) представляет собой определенный химический элемент или соединение, то для него можно записать уравнение химической реакции горения. В этом случае состав и содержание продуктов полного сгорания можно определить непосредственно по уравнению реакции горения. Рассмотрим порядок расчета на примере горения этилацетата СН3–СОО–С2Н5 при нормальных условиях (Т=0°С, р=760 мм Hg) · Запишем уравнение реакции горения: СН3–СОО–С2Н5+5О2=4СО2–4Н2О. · В это уравнение подставим значения молекулярных масс входящих в него элементов:
· Определим массу продуктов сгорания, образующихся при полном сгорании 1 кг этилацетата:
· По известной плотности углекислого газа (r=1.977 кг/м3) и паров воды (r=0.804 кг/м3) при нормальных физических условиях, определим объем продуктов сгорания 1 кг этилацетата:
Таким образом, при полном сгорании 1 кг этилацетата при нормальных физических условиях образуется 1.01 м3 углекислого газа и 1.02 м3 паров воды. В ряде случаев необходимо определить состав сухих продуктов сгорания, то есть без учета паров воды. В состав сухих продуктов сгорания этилацетата входит только углекислый газ СО2. Горючее вещество – смесь газов В состав технических газов входят метан, водород, оксид углерода, этан, бутан, пропан и другие газы. Количество и состав газообразных продуктов сгорания для смеси газов можно определить с помощью уравнений реакций горения входящих в смесь компонентов. Рассмотрим порядок расчета состава и количества газообразных продуктов полного сгорания на примере светильного газа, состав которого приведен в табл. 4.7. Таблица 4.7 Состав светильного газа
· Запишем уравнения реакций горения входящих в смесь газов. Горение угарного газа: 2СО+О2=2СО2. Горение метана: СН4+2О2=СО2+2Н2О. Горение водорода: 2Н2+О2=2Н2О. Углекислый газ является продуктом полного горения, поэтому для него уравнение реакции не записывается. · Подставим в эти уравнения молекулярные массы входящих в них элементов. Для горения угарного газа:
Для горения метана:
Для горения водорода:
· Определим массу продуктов сгорания 1 кг каждого из компонентов смеси.
Для горения угарного газа:
Для горения метана:
Для горения водорода:
· Определим объем продуктов сгорания 1 кг каждого из компонентов по известным значениям их плотности при нормальных физических условиях.
Для горения угарного газа:
Для горения метана:
Для горения водорода:
· Определим объем продуктов сгорания 1 м3 каждого из компонентов по известным значениям их плотности при нормальных физических условиях. Для горения угарного газа (r=1.25 кг/м3):
Для горения метана (r=0.717 кг/м3):
Для горения водорода (r=0.09 кг/м3):
· Суммируя полученные объемы продуктов сгорания при горении угарного газа, метана и водорода (с учетом их процентного содержания в смеси), можно определить общее количество продуктов сгорания:
Таким образом, суммарный объем продуктов сгорания
включая 0.05 м3 углекислого газа, содержащегося в исходной смеси. Аналогичным способом можно рассчитать объем газообразных продуктов, образующихся при полном сгорании 1 м3 любого конкретного газа. Для некоторых распространенных газов результаты расчетов приведены в табл. 4.8. Таблица 4.8
Состав и объем газообразных продуктов,
С помощью табл. 4.8. можно определить как состав продуктов полного сгорания, так и их процентное содержание в любой горючей смеси, состоящей из приведенных в таблице газов. Горючее вещество – смесь сложных химических соединений Если известен элементарный состав сложного вещества, то есть его эквивалентная формула, то состав и количество газообразных продуктов сгорания 1 кг вещества можно определить по уравнениям реакций горения основных горючих компонентов – водорода, углерода и серы. При этом записывается уравнение реакции горения, например, для углерода: С+О2=СО2. В уравнение подставляются молекулярные массы элементов: . Определяются масса и объем углекислого газа, образующегося при полном сгорании 1 кг углерода:
Аналогично определяются масса и объем газообразных продуктов полного
сгорания водорода и серы. Если в составе топлива содержатся азот
N2, влага W
и зола A, то они в процессе горения
не участвуют. Эти компоненты переходят в газообразное состояние и
смешиваются с остальными продуктами горения. При
нормальных физических условиях 1 кг
азота имеет объем В табл. 4.9 приведены состав и объем газообразных продуктов, образующихся при полном сгорании 1 кг горючих веществ. Таблица 4.9
Количество газообразных продуктов (м3),
Пользуясь этими данными, можно определить количество продуктов горения, если известен элементарный состав любого топлива. В качестве примера определим количество продуктов сгорания 1 кг каменного угля (табл. 4.10). Таблица 4.9 Элементарный состав угля
Используя данные табл. 4.9, 4.10 определим объем газообразных продуктов полного сгорания:
|