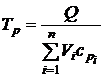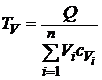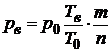|
8.5. РАСЧЕТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ ВЗРЫВА Для каждой горючей смеси газов существуют две теоретические температуры взрыва – при постоянном давлении Тp и постоянном объеме ТV, причем всегда Тp < ТV. Это связано с тем, что удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме (cp>cV). Температура Тp соответствует взрыву на открытом воздухе, а ТV – взрыву в замкнутом объеме или помещении. Расчет температур взрыва Тp и ТV базируется на уравнениях теплового баланса:
Здесь Q – теплота горения вещества;
Значения теоретической температуры взрыва рассчитываются с помощью уравнений теплового баланса (8.5), (8.6):
Разность между теоретической и действительной температурой взрыва значительно меньше, чем соответствующая разность между температурами горения. Это связано с тем, что при взрыве процесс протекает при условиях, близких к адиабатическим. При этом, ввиду того, что процесс взрыва протекает чрезвычайно быстро, потери теплоты в окружающую среду малы. Давление при взрыве смеси горючих газов с воздухом в замкнутом объеме зависит от температуры взрыва и отношения числа молекул продуктов горения к числу молекул во взрывчатой смеси. При взрыве газовых смесей избыточное давление обычно не превышает 1 МПа. При замене воздуха во взрывчатой смеси на кислород, давление при взрыве резко увеличивается за счет увеличения температуры горения. Это связано с тем, что значительное количество теплоты затрачивается на нагрев инертного газа – азота, входящего в состав воздуха. При замене воздуха на кислород, давление взрыва для большинства горючих веществ увеличивается от 1 МПа до (1.5÷2) МПа. Для расчета давления взрыва используется формула
где Т0 – начальная температура смеси, K; Тв – температура взрыва, К (в зависимости от условий взрыва в качестве температуры взрыва используются либо Tp либо TV); р0 и рв – начальное давление среды и давление при взрыве, МПа; m – число молекул в химической формуле исходной взрывчатой смеси; n – число молекул в химической формуле продуктов взрыва. В качестве примера определим давление при взрыве окиси углерода на открытом воздухом при следующих условиях:
р0=0.1 МПа; Т0=293 К (или +20°С); Тв=Тp=2416 К.
· Найдем значения m и n в соответствии с протекающей реакцией:
2СО+О2=2 СО2.
При этом m=3, n=2, так как взрывчатая смесь содержит две молекулы СО и одну молекулу кислорода, а продукты взрыва содержат две молекулы СО2. · Определим давление взрыва по формуле (8.6):
Таким образом, при взрыве смеси
воздуха с угарным газом на открытом воздухе развивается давление
|