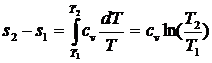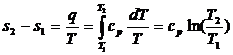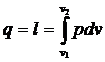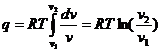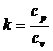|
2. Законы термодинамики В основе термодинамики как науки лежат её первый и второй законы, устанавливающие качественные и количественные взаимосвязи между теплотой и механической работой [2]. Первый закон термодинамики устанавливает количественную связь между теплотой и механической энергиями и представляет собой балансовое уравнение изменения энергии в термодинамической системе: u2 - u1 = q – l+ a, (2.1.) где (u2 – u1) - изменение удельной внутренней энергии; q – удельная теплота c которой тело обменивается энергией с окру жающей средой; l – удельная работа по изменению объёма; a – работа немеханического характера. К работе немеханического характера можно отнести работу по переносу электрического заряда, работу (теплоту) химического взаимодействия и др. Если считать, что a = 0, то u2 – u1= q – l. В математическом выражении первого закона термодинамики принято подводимую к телу теплоту выражать как функцию внутренней энергии и работы:
q
=u2
-
u1
+
l,
Тогда первый закон термодинамики с учётом (2.2.) формулируется следующим образом: вся подводимая к телу теплота идёт на изменение внутренней энергии и на совершение работы. Отметим, что первый закон термодинамики, описывающий эквивалентное превращение теплоты и механической энергии, является частным случаем закона сохранения и превращения энергии, открытого М.В.Ломоносовым. Из молекулярно-кинетической теории следует, что внутренняя энергия тела пропорциональна его температуре, тогда её изменение будет пропорционально разности температур, т.е. U2 – U1 = cv (T2 – T1) (2.3) Удельная работа расширения l в уравнении (2.2.) совершается против внешних сил, например расширение газа в цилиндре при постоянном давлении, и аналитически выражается следующим образом: l = p (v2 – v1), (2.4) где p – полное (абсолютное) давление газа, м3/кг. С учётом уравнений (2.3) и (2.4) первый закон термодинамики можно представить в развёрнутом виде:
q
=
cv
(T2
–
T1)+
p
(v2
–
v1),
Уравнение (2.5) часто используется при описании работы теплоэнергетических машин и установок, а так же для анализа типовых термодинамических процессов в газах, которые являются частными случаями первого закона термодинамики. Теоретически измененные состояния газа полностью характеризуются тремя параметрами p, v и T, при этом теплота либо подводится к газу, либо отводится от него. Такие процессы называются политропными*. Наибольший практический интерес представляют такие процессы, в которых один из основных параметров остаётся постоянным, или процесс осуществляется без теплообмена с окружающей средой. Таких процессов в природе существует четыре: - изохорный (v = const); - изобарный (p = const); - изотермический (T = const); - адиабатный (dq = 0) При исследовании термодинамических процессов обычно определяют: - зависимости между изменяющимися параметрами газа; - количество теплоты подводимой к рабочему телу; - изменение внутренней энергии; - работу расширения газа.
Все процессы при этом рассматриваются как равновесные и обратимые, а их исследование осуществляется на основе уравнения состояния идеального газа и первого закона термодинамики. Изохорный процесс – это равновесный процесс, протекающий при постоянном объёме (v=const). Такой процесс осуществляется, например, при нагревании или охлаждении газа в замкнутом объёме. Так как в изохорном процессе не происходит изменение объёма, то уравнение первого закона термодинамики (2.5) при (v2 – v1) =0 будет иметь следующий вид:
q
=
cv
(T2
–
T1),
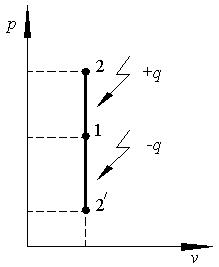
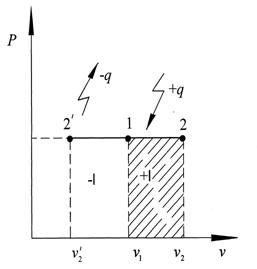
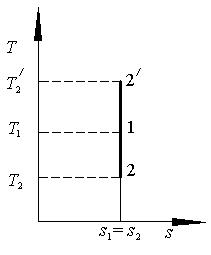
т.е. в изохорном процессе вся подводимая к телу теплота идёт на изменение его внутренней энергии. Уравнение (2.6) определяет внутреннюю энергию 1кг газа в изохорном процессе, а его полная внутренняя энергия (m кг) определяется по уравнению(2.7): Q = cv m (T2 – T1), Дж (2.7) В p – v координатах изохорный процесс изображается вертикальным отрезком (рис.2.1).
______________ · «поли» - много
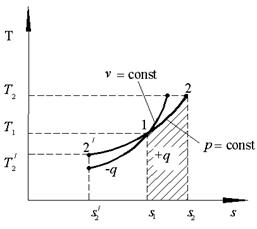
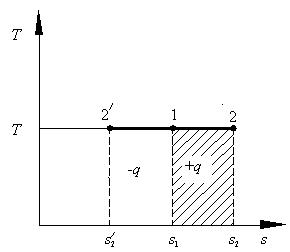
Как следует из выражения (2.9), линия изохорного процесса в T–S координатах являются логарифмической кривой (рис 2.2).
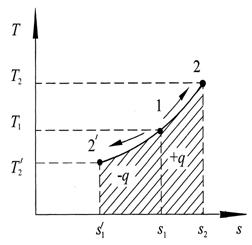
горизонтальный отрезок. На рис. 2.3 в процессе 1–2 теплота q подводится к рабочему телу и совершается работа расширения. Для изобарного процесса уравнение первого закона термодинамики (2.5) применяется в общем виде, но вместо изохорной теплоёмкости cv используется изобарная, т.е. теплоёмкость при постоянном давлении cp:
Тогда можно заключить, что в изобарном процессе часть подводимой к телу теплоты переходит в его внутреннюю энергию, а другая часть превращается в работу расширения. Для построения изобарного процесса в T-s координатах подставим значение удельной теплоты q в общую формулу удельной энтропии для конечного процесса:
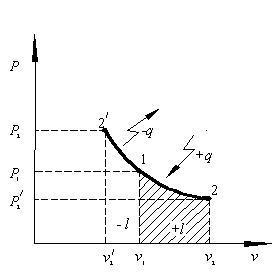
сопровождающегося сжатием или расширением газа, находящегося под поршнем в цилиндре с идеально теплопроводными стенками. Очевидно, что в T – s координатах изотерма представляет собой горизонтальный отрезок прямой (рис.2.6), так как подвод и отвод теплоты не вызывает изменения температуры рабочего тела. В связи с тем, что при постоянной температуре внутренняя энергия тела не изменяется (T2 – T1 = 0), то вся подводимая к телу теплота расходуется на совершение работы. Тогда первый закон термодинамики (2.1) будет иметь следующий вид:
С
учетом уравнения состояния идеального газа можно принять
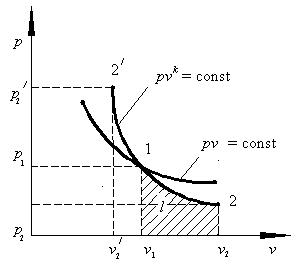
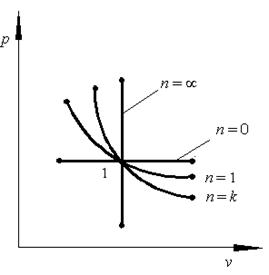
Сопоставляя уравнения четырёх рассмотренных процессов в p – v координатах можно установить, что они описываются произведением( p v) и отличаются друг от друга показателем степени при v :
-
изохорный процесс - изобарный процесс p = const (n = 0 ) ; - изотермический процесс p v = const (n =1 ) ; - адиабатный процесс p vk = const (n =k ). Тогда все эти процессы можно описать одним обобщающим уравнением (2.17): pvn = const, (2.17) Такой обобщающий процесс называется политропным, а n – показатель политропы. Для наглядного сопоставления исследуемых процессов изобразим на одном рисунке все четыре графика, проходящие через общую точку 1 (рис. 2.9).
|
||||||||||||||||||||||